Uno tra i grandi problemi per chi si occupa di atmosfere esplosive consiste nella modellazione di scenari il più possibile aderenti alla realtà del fenomeno di rilascio/dispersione.
Ad essere sinceri è questo un mio autentico “pallino”: cercare di realizzare “mappature” sovrapponibili al “territorio” di rischio che devono rappresentare.
Diversamente, assunzioni plurime di coefficienti di sicurezza unite a semplificazioni (magari fatte con abbondanti vantaggi di sicurezza), rischiano di trasformare la “mappatura” di Moncalvo in quella di Londra.
- È legittimo assimilare una miscela di azoto e idrogeno al solo idrogeno?
- È legittimo assimilare una miscela polveri combustibili a varia granulometria con la sola frazione più sottile?
- È legittimo prendere la sostanza più infiammabile quale quella più rappresentativa di un mix produttivo costituito da centinaia di codici differenti?
- È legittimo assumere rappresentativa la sostanza più infiammabile presente nella scheda di sicurezza di una miscela?
- È legittimo considerare rappresentativa la sostanza infiammabile di un mix binario in cui l’altro componente è acqua?
Potrei continuare.
Spero però di aver reso il senso.
Non esistono risposte conclusive alle domande che ho esposto. Mi rifugio, pertanto, nel molto ingegneristico: “dipende dalle condizioni”.
In realtà il “dipende” appena accennato vale per tutte le risposte tranne una: l’ultima.
Il caso delle miscele tra infiammabili e acqua merita sempre approfondimento: è infatti abbastanza semplice comprendere se tale mix sia incluso o meno nel campo applicativo delle direttive ATEX.
Vogliamo fare un esempio?
Proviamoci.
Immaginiamo che il servizio di prevenzione e protezione di un mobilificio abbia prescritto che il lavaggio delle morchie di verniciatura debba essere eseguito non con acetone puro ma con una miscela acqua-acetone (50-50 mol/mol) perché, a sua opinione, con questa modalità si attenuano le caratteristiche di infiammabilità.
Immaginiamo, ancora, che voi siate chiamati per dare un parere tecnico sulla cosa, stante un recente accadimento incidentale, non grave, che ha messo in discussione l’assunto di base (=attenuazione delle caratteristiche di infiammabilità della miscela con la diluzione in acqua).
Vi orientate, preliminarmente, alla determinazione del flashpoint della miscela. Il dubbio, infatti, è che un mix al 50-50 molare non sia sufficiente a rendere “non infiammabile” il prodotto utilizzato per il lavaggio.
La prima cosa da fare, quindi, è comprendere quali siano le caratteristiche di infiammabilità del liquido che si sta studiando: la banca dati dell’ECHA, a questo proposito, rappresenta lo stato dell’arte.
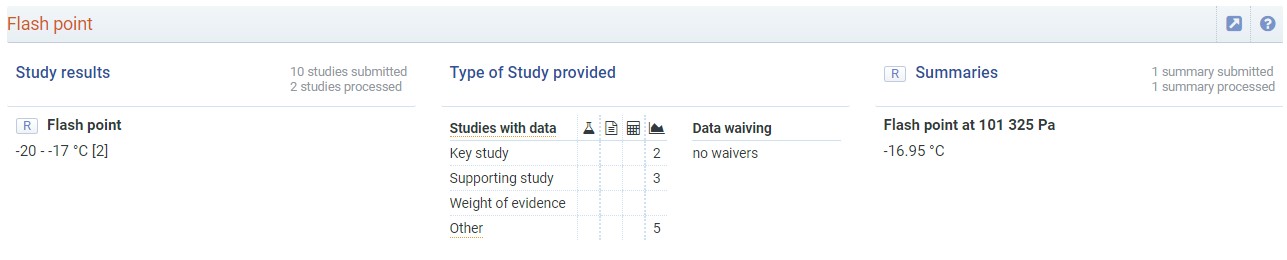 Scopriamo che il flashpoint dell’acetone è pari a circa -17°C. Il liquido allo stato puro, e in condizioni atmosferiche di pressione e temperatura, è cioè circa 40°C sopra il suo punto di infiammabilità.
Scopriamo che il flashpoint dell’acetone è pari a circa -17°C. Il liquido allo stato puro, e in condizioni atmosferiche di pressione e temperatura, è cioè circa 40°C sopra il suo punto di infiammabilità.
Il problema è che dobbiamo valutare la sua pericolosità in miscela con l’acqua. Per fare questo è indispensabile conoscere quale sia la relazione che correla la tensione di vapore dell’infiammabile alla temperatura. In sintesi, dobbiamo andare alla ricerca dei coefficienti di Antoine. A questo proposito la banca dati del NIST americano fa al caso nostro (pressione in bar, temperatura in K).
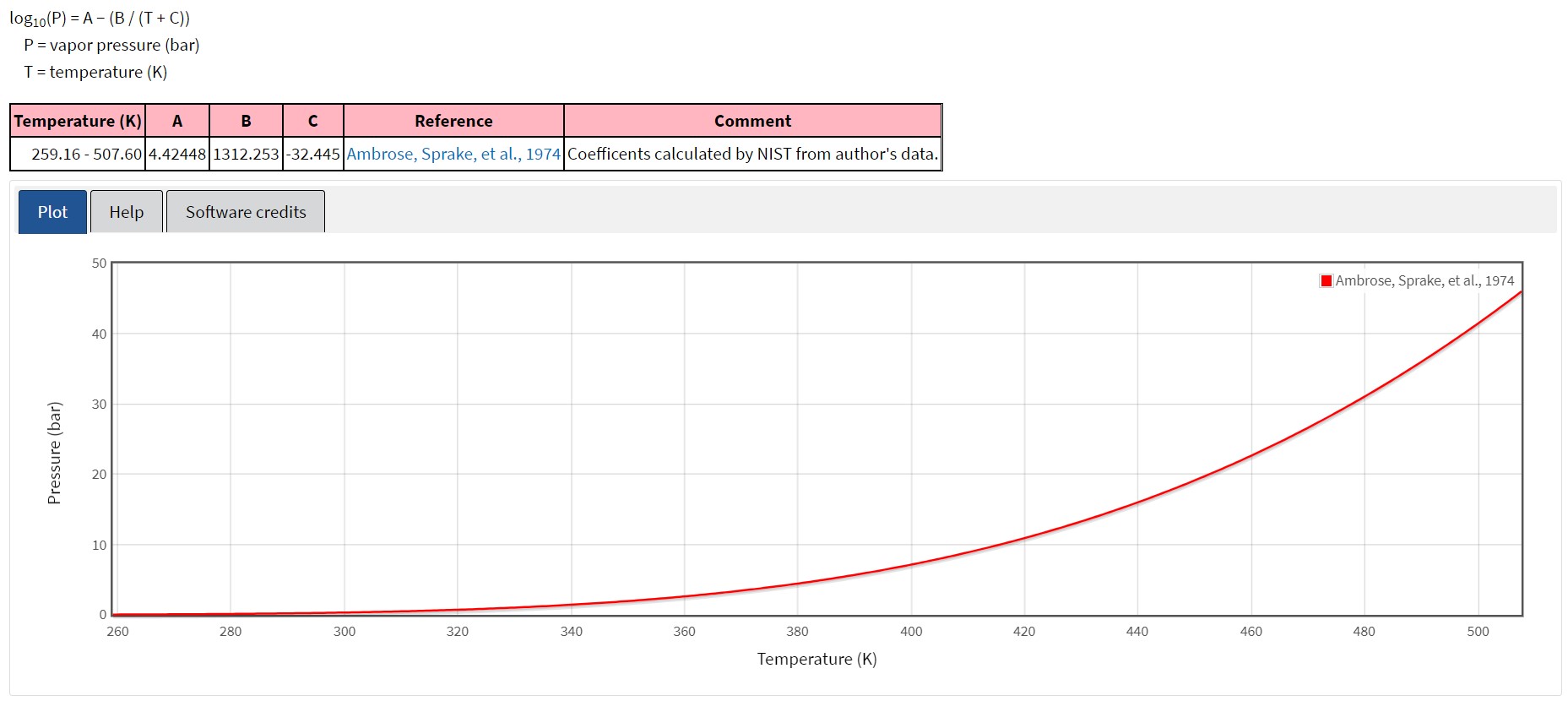 Non è purtroppo finita qui: dobbiamo simulare, per quanto possibile, la miscela reale con la legge di Raoult. Ma non essendoci le condizioni di idealità[1] dobbiamo ricorrere agli strumenti della termodinamica chimica.
Non è purtroppo finita qui: dobbiamo simulare, per quanto possibile, la miscela reale con la legge di Raoult. Ma non essendoci le condizioni di idealità[1] dobbiamo ricorrere agli strumenti della termodinamica chimica.
Scegliamo il modello dei coefficienti di attività di Margules.
Per “metterli a terra” è però necessario ricorrere alla “bibbia” dell’ingegneria chimica: il Perry’s (la mia edizione è quella del 1999).
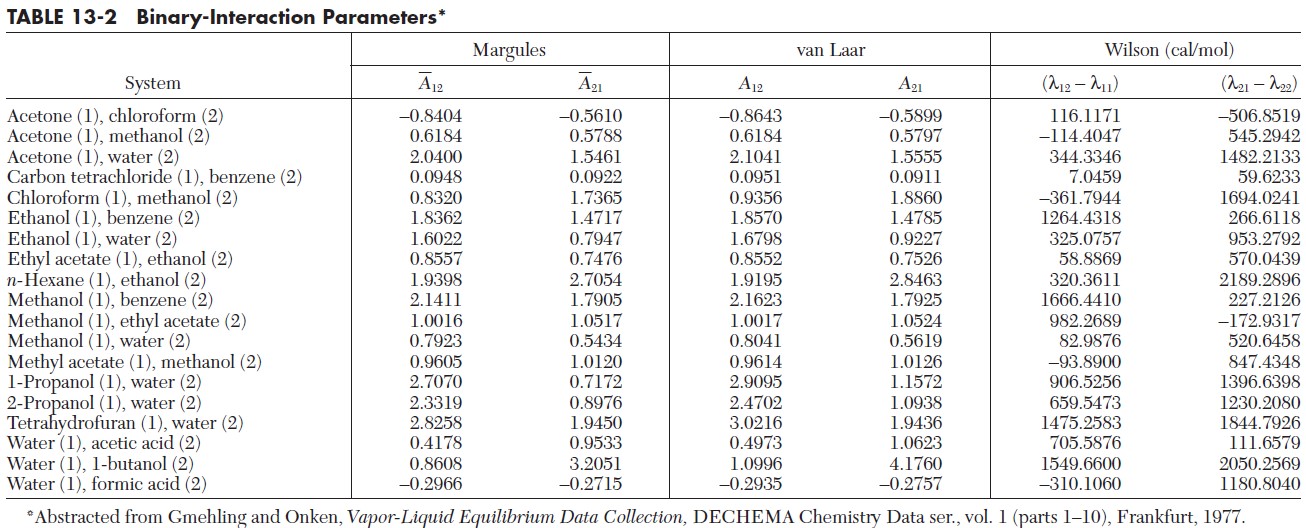
Scopriamo che la miscela acetone (1) – acqua (2) possiede i seguenti parametri di Margules di interazione binaria:
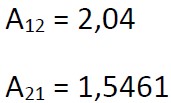
Non sono correlati alla temperatura, dovremmo per questo passare a banche dati più affidabili che forniscano i coefficienti di attività a diluizione infinita a specifiche condizioni di P e T.
Tuttavia per lo scopo che ci proponiamo va più che bene così.
Facciamo nostra la teorizzazione di Hristova sulle miscele idroalcoliche (valida anche nel caso in esame) e procediamo finalmente al calcolo del flashpoint.
Poiché:
![]()
Si ha:
![]()
La tensione di vapore (pFP) alla temperatura del flash point (TFP) dell’infiammabile puro (x1 = 1) si calcola a partire dall’equazione di Antoine:
![]()
La conseguente pressione di flash point relativa alla frazione molare di infiammabile (x1 = 0,5) in miscela con acqua è invece calcolabile con la seguente relazione:
![]()
La temperatura di flash point di una miscela 0,5 molare di acetone in acqua è, infine, la seguente:
![]()
Molto, molto inferiore alle condizioni ambientali. L’acetone, quindi, anche se diluito al 50% molare permane infiammabile.
Per converso, il flashpoint della miscela acetone-acqua raggiunge la temperatura ambiente per concentrazioni molari d’acqua del 98% circa (corrispondenti a circa il 92% in volume).
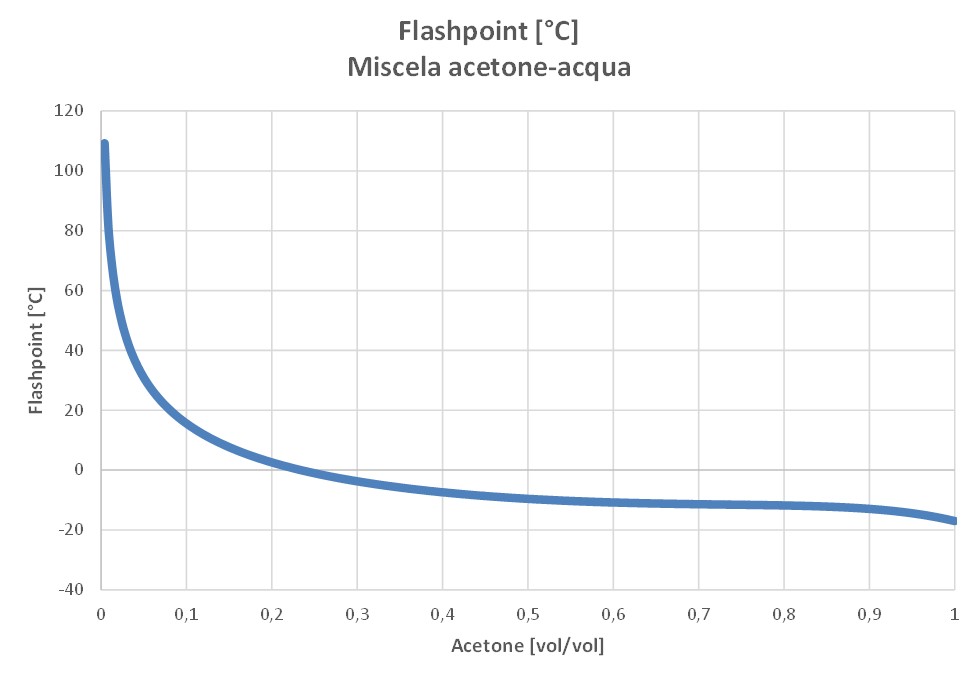
Due considerazioni, quindi, a valle dell’evento incidentale.
La prima: la concentrazione espressa in termini molari. La molarità è “roba” per chimici duri. I comuni mortali, meccanici in testa, è meglio si esprimano in termini di frazioni volumetriche o di massa. Facendo infatti l’ipotesi di miscela ideale e assumendo i seguenti volumi molari dei singoli componenti (DIPPR 801, 2023):

la concentrazione 50-50 mol/mol corrisponde ad una concentrazione in volume di acetone dell’80%.
Meglio, molto meglio, quindi esprimersi in concentrazioni vol/vol più intuitive e comprensibili.
La seconda: la diluzione dell’acetone con acqua non è una misura efficace per prevenire la formazione di ATEX. Questo, ovviamente, nell’ipotesi di operare a temperatura ambiente. Come si vede infatti dalla curva precedente, gli effetti dell’incremento del flashpoint sono davvero minimi anche in presenza di rilevanti aggiunte d’acqua (nel range di concentrazione di acetone 0,4-0,9 vol/vol la curva è assimilabile ad una retta orizzontale).
A presto!
Marzio
PS – Chi sia interessato alla tabulazione completa dei dati in Excel, mi scriva pure la mail qui sotto.
PPS – Ricordo a tutti il fantastico Webinar ATEX 2023! Quest’anno, a differenza di altre occasioni, vorrei limitarlo nella quantità di partecipanti così da favorire l’interazione. I posti sono quindi limitati. Peraltro le iscrizioni ad oggi arrivate consentono di confermare, fin da ora, la sua realizzazione.
[1] Tutti noi siamo intrisi di cultura dell’idealità. Dalle scuole superiori all’università, infatti, la prima assunzione che si fa per spiegare il mondo che ci circonda è la seguente: “ipotizziamo che il [fenomeno da studiare a caso] si comporti in modo ideale”. Va bene per comprendere. Poi però esiste il mondo reale. Più complicato.



Commenti (7)
Davide Levo - 3 Gennaio 2023
Forse era più facile misurare il flashpoint della miscela piuttosto che calcolarlo, giusto per rimanere il più possibile nel mondo reale … 🙂
Marzio Marigo - 4 Gennaio 2023
Buongiorno
I test sperimentali sono fondamentali e insostituibili.
Ma è molto meglio eseguirli dopo un’analisi che indichi quali siano le composizioni interessanti dal nostro punto di vista.
Grazie
MM
Ginobili Euro - 4 Gennaio 2023
Buon giorno Ingegnere, interessante ed utile articolo.
Sono interessato a ricevere la tabulazione completa dei dati in excell.
Grazie mille.
Thomas Marson - 6 Gennaio 2023
Buon giorno Marzio, articoli sempre super interessanbti e utili.
Sono interessato a ricevere la tabulazione completa dei dati in excell in particolare la modalità di definizione del grafico di andamento flash point cosi da poterlo applicare per altre sostanze.
Grazie mille.
Pasquale Salatino - 5 Ottobre 2023
Buongiorno Ingegnere, potrei avere la tabulazione excel?
Grazie e complimenti: articoli sempre interessanti.
FRANCESCA MELANDRI - 11 Dicembre 2023
Buongiorno ingegnere,
l’articolo è molto interessante e sono interessata a ricevere la tabulazione completa in excel.
Grazie.
Alessandro Dozza - 15 Aprile 2024
Salve Marzio, grazie per l’articolo molto istruttivo per dare idea del comportamento del solvente, se le è possibile ricevo volentieri il foglio excel per fare un po di esercizio ed info.
Cordiali Saluti
Alessandro