Oggi discutiamo di alcune tra le proprietà dell’acetilene (etino), un idrocarburo diffusamente impiegato in vari settori industriali e scientifici.
Certo, comprendo ci possano essere argomenti più interessanti. Tuttavia i gusti sono gusti. E, come disse Silvio Ceccato:
Le cose non sono di per sé interessanti, ma lo diventano solamente se ce ne interessiamo
L’acetilene è un gas industriale scoperto in tempi (relativamente) recenti: data infatti 1860 il “battesimo” della sostanza, prodotta dalla reazione tra carbonato di calcio e acqua. Fu il chimico francese Marcelin Berthelot che ne investigò le proprietà e le relazioni con l’etilene e con il metano.
È necessario però attendere ulteriori 40 anni per il suo primo, diffuso, utilizzo. Tra il 1895 e il 1900, infatti, l’elevata temperatura di fiamma, e la conseguente brillantezza, ne consentì una rapida adozione per l’illuminazione urbana in sostituzione del gas di città e dell’olio combustibile.
Peraltro, a partire dal 1900 l’utilizzo esteso della fiamma ossiacetilenica rivoluzionò le modalità di saldatura; questa raggiunge infatti i 3200°C, molto superiore alle temperature prodotte dalle torce ossimetaniche ed ossidriche[1].
Successivamente, a partire dal primo dopoguerra, l’introduzione dell’illuminazione elettrica e della saldatura ad arco soppiantò l’utilizzo dell’acetilene. L’etino venne comunque estesamente utilizzato anche tra le due guerre, in quanto materia prima base per la chimica dei polimeri. Negli anni ’70, l’acetilene fu definitivamente sostituito dall’etilene nel settore chimico, segnando una svolta significativa nell’industria. La disponibilità di alternative più economiche e sicure, unite ai progressi tecnologici, portò a un progressivo declino del suo impiego in tutti gli altri settori.
Ad oggi il mercato complessivo di questo gas è valutato di 3,8 miliardi di USD nel 2023 con trend di crescita del 5,3% nel 2024 corrispondenti a circa 11,38 milioni di tonnellate. Per avere un termine di paragone, il quantitativo di ossigeno commercializzato nel 2023 è stato pari a 513,41 milioni di tonnellate, circa 45 volte volte l’acetilene.
Fin qui la storia breve di questo gas.
Dove incontriamo l’acetilene nell’attuale realtà industriale italiana?
Dappertutto.
Il “carrellino” con le bombole ossiacetileniche lo si può trovare, davvero, ovunque. Meno frequente, ma pur sempre rilevante, è l’installazione di sistemi centralizzati di alimentazione con pacchi bombole delle torce di saldatura.
Più settoriali, ma comunque diffuse, sono invece le applicazioni dell’acetilene nella sintesi chimica di composti organici (solventi, additivi per polimeri e componenti per profumi), in alcuni trattamenti termici (es. carbocementazione) e nella produzione di materiali con caratteristiche tecnologiche avanzate (es. nanotubi in carbonio, CNT).
In termini di sicurezza questo gas può dare parecchi grattacapi: decomposizione a basse pressioni, MIE[2] estremamente bassa, campo di infiammabilità esteso, necessità di valvole di sicurezza per evitare i ritorni di fiamma, limitata tendenza al galleggiamento e reazione con particolari forme di metallo sono solo alcuni degli aspetti riferibili alla sicurezza.
Ed è solo un elenco parziale.
Nel video seguente troviamo degli esperimenti realizzati (ovviamente da non ripetere a casa!!!), che dettagliano la violenza e la rapidità della combustione comparando propano in aria, acetilene in aria e acetilene in ossigeno. Consiglio di abbassare l’audio…
Pur consapevole di non esaurire il tema, vorrei qui soffermarmi su due aspetti significativi che caratterizzano il comportamento di questo strano gas.
Le chiameremo “Cosille”
LA PRIMA COSILLA: Andamento della MIE rispetto alla concentrazione nell’aria
Osserviamo attentamente l’immagine che segue.
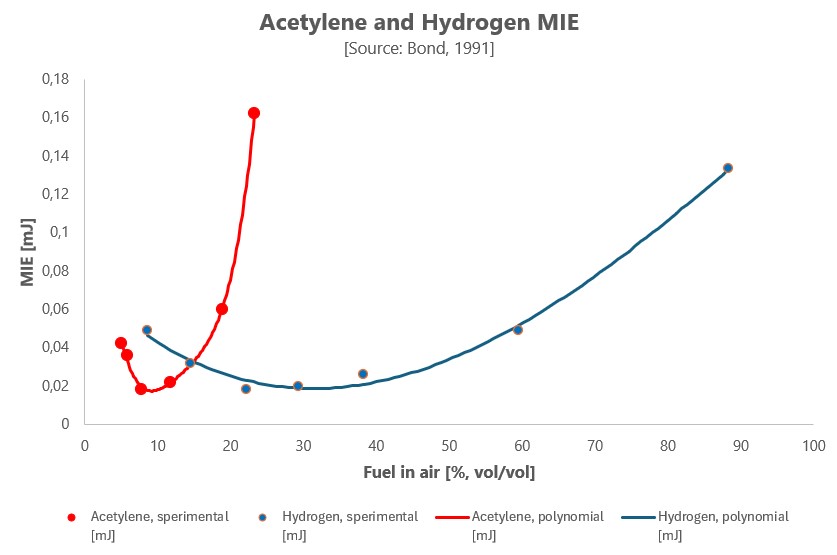 Fonte: Elaborazione da Calcote, H. F., Gregory, C. A., Barnett, C. M., & Gilmer, R. B. (1952). Spark Ignition. Effect of Molecular Structure. Industrial & Engineering Chemistry, 44(11), 2656-2662 tratta da Bond, J. (1991). Sources of ignition: flammability characteristics of chemicals and products. Elsevier
Fonte: Elaborazione da Calcote, H. F., Gregory, C. A., Barnett, C. M., & Gilmer, R. B. (1952). Spark Ignition. Effect of Molecular Structure. Industrial & Engineering Chemistry, 44(11), 2656-2662 tratta da Bond, J. (1991). Sources of ignition: flammability characteristics of chemicals and products. Elsevier
Come si vede, il campo di infiammabilità per l’acetilene è apparentemente meno accentuato rispetto all’idrogeno. Mentre infatti nel caso di quest’ultimo gas (H2) è bene immaginabile un ampio campo di infiammabilità ad alte energie di accensione, per l’acetilene è meno intuibile. Pare esista un asintoto collocato tra il 30% e il 40% con l’aria.
Nella norma 80079-20-1, tuttavia, troviamo l’indicazione che l’UFL dell’acetilene arriva al 100%.
Perché?
Perché, per questa sostanza di sintesi, l’accensione del gas ha luogo sia in PRESENZA che in ASSENZA di aria (il 100% questo significa: solo acetilene e 0% di ossigeno). A questo proposito la banca dati chemsafe fissa a 0,8 bar relativi la pressione limite di decomposizione del C2H2. Tale valore sperimentale è proporzionale all’energia di accensione e aumenta al diminuire di questa.
Fonte: https://www.chemsafe.ptb.de
L’acetilene, cioè, si comporta sia come gas infiammabile sia come sostanza chimicamente instabile che può decomporsi in modo esplosivo anche in assenza di ossigeno. È per questo che il limite superiore di infiammabilità arriva al 100%.
Altri fatterelli collegati:
- la LMIE (dove “L” sta per Low) non superiore a 0,017 mJ al 8,5% (è un IIC, infatti) equivalente (meccanicamente) ad uno spillo che cade da 1,7 mm. In ossigeno, invece, l’energia meccanica equivalente alla LMIE sarà di 0,0002 mJ (al 40% di O2) equivalente uno spillo lasciato cadere da 2 centesimi di millimetro). Da QUI (ma solo fino a Natale), è possibile il download del potentissimo foglio di calcolo “spilli”, che calcola l’equivalenza meccanica della LMIE in termini di “spillo-equivalenza” (il mio regalo di Natale)
- fino al 23%, l’energia di accensione in aria è inferiore a quella del metano
- il campo di infiammabilità va dal 2,3 al 100% in aria (il gas è SEMPRE infiammabile, a qualsiasi concentrazione)
Questa sostanza non ha solo una bassissima energia di accensione: ha anche un estesissimo campo di infiammabilità (seppur con energie di accensione meno “spanciate” verso il basso rispetto all’idrogeno[3]).
È questo il peggior pericolo? Secondo me si, ma parità di un altro che coinvolge una specifica proprietà non sempre immediatamente compresa. Veniamo, quindi, alla seconda cosilla.
LA SECONDA COSILLA: Trasporto e stoccaggio
Il trasporto e lo stoccaggio dell’etino ha luogo in forma di gas disciolto in acetone o dimetilformammide[4]. Per evitare esplosioni[5], dovute a desorbimento rapido[6], si ricorre a materiali fortemente porosi[7] che limitano lo scuotimento di grande masse di liquido. L’invenzione di tale stratagemma di sicurezza pare sia dovuto a Le Chatelier[8] in persona (si, proprio lui!).
Una tipica bombola di acetilene da 40 litri pesa 60 kg ed è composta, piena, da:
- Solvente: 19 kg
- Struttura metallica: 30 kg
- Massa porosa interna : 5 kg
- Acetilene: 6 kg
con un rapporto acetilene/solvente pari al 31,6%.
Durante l’esercizio il desorbimento, progressivamente, riduce la quantità di acetilene fino a svuotare il cilindro a pressione. La bombola esausta peserà, quindi, 54 kg[9].
Il calcolo della pressione interna di una bombola di acetilene disciolto in acetone non è tuttavia banale. Necessita di risorse analitiche non sempre disponibili. Ma noi non ci demoralizziamo e tentiamo di risolvere comunque la questione.
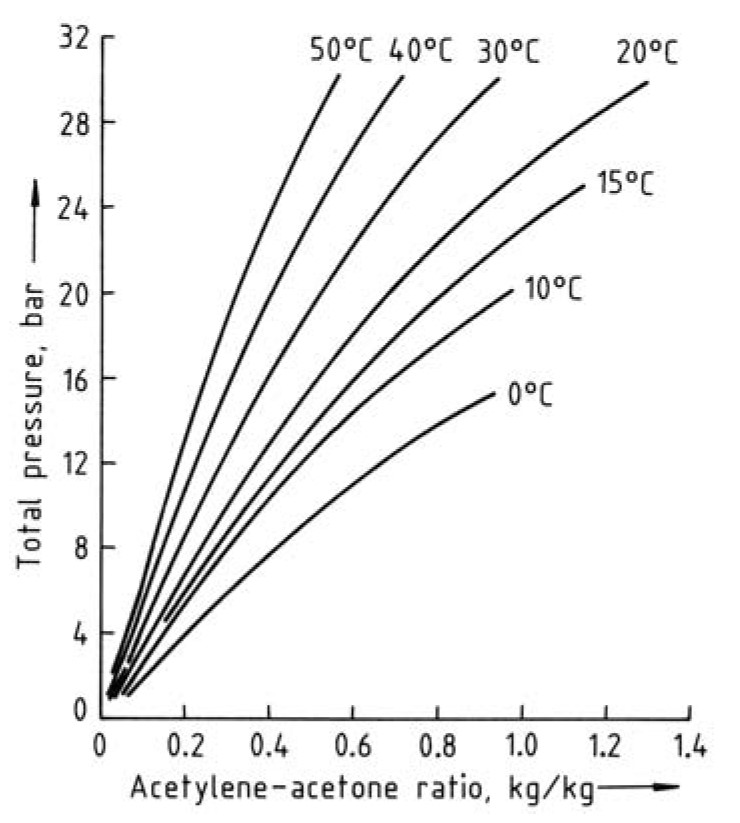 Fonte: Beard, A., Battenberg, C., & Sutker, B. J. (2021). Ullmann’s Encyclopedia of Industrial Chemistry
Fonte: Beard, A., Battenberg, C., & Sutker, B. J. (2021). Ullmann’s Encyclopedia of Industrial Chemistry
Con l’aiuto di dati sperimentali osserviamo che nel caso dell’acetilene la pressione varierà con la temperatura. In particolare, si ha:
- p(20°C) = 10,4 bar
- p(50°C) = 19,8 bar
L’aumento di soli 30°C causa un raddoppio della pressione all’interno della bombola di acetilene[10]. Per confronto, una bombola di gas compresso sottoposta alla stessa differenza di temperatura, incrementa la propria pressione interna di circa il 10%.
Attenzione, dunque, allo stoccaggio dei pacchi bombole o dei “carrellini” all’esterno del reparto: un giorno estivo assolato a Porto Palo di Capo Passero piuttosto che a Stoccolma può fare la differenza!
Sulla sicurezza dell’etino molto altro ci sarebbe da dire.
Mi fermo però qui; è un blog, in fondo, mica un manuale.
Arrivo quindi al vero motivo che mi ha spinto alla scrittura del post: augurare a tutti noi di trascorrere un periodo di riposo ristoratore. Rallentiamo un po’.
Ci farà bene.
A presto!
Marzio
– – –
[1] La fiamma ossidrica, contrariamente alla credenza giornalistica, non è diffusa nell’ambito della tecnologia meccanica. La torcia ossimetanica invece, in virtù dell’accentuata tendenza al galleggiamento del gas, può trovare applicazione soprattutto negli spazi confinati, compensando così con maggiore sicurezza la minor efficienza saldante.
[2] MIE: Minima Energia di Accensione
[3] L’idrogeno, dal punto di vista dell’energia di accensione, è un po’ più “cattivo”: manifesta MIE molto basse anche a concentrazione molto alte e distanti dalla 22,1%, valore in corrispondenza del quale la MIE è minima.
[4] DMF
[5] Molto frequenti all’inizio del 1900.
[6] una sorta di effervescenza “plus”… immaginiamo le bollicine di anidride carbonica, che si separano dalla coca-cola, quando ci cade una bottiglietta
[7] Modern Monolithic Porous Material, MMPM, che possiede il 92% di microporosità
[8] “To prevent (explosion), a porous mass used was used, from an idea by Henri Le Chatelier. The mass created a fine capillary system into which the acetone was absorbed. Since an explosion cannot spread in a space having a diameter of a fraction of a millimeter, in theory, the risk of explosion was eliminated. Claude and Hess launched their invention in 1896, and in the following year the Compagnie Francais de l’Acetylene Dissous (CFAD) was founded” (Almqvist, E. (2012). History of industrial gases. Springer Science & Business Media. 112-113)
[9] Interessante la tecnologia di ricarica della bombola che deve rispettare specifiche velocità. Non c’è spazio, qui, per approfondire.
[10] Equazioni che consentono il calcolo preciso della pressione di stoccaggio sono rinvenibili in EIGA 26:2021 e UNI EN ISO 11372:2012


Commenti (4)
Massimo - 21 Dicembre 2024
Molto interessante questo articolo,grazie
Marzio Marigo - 5 Gennaio 2025
Grazie Massimo!
🙂
Davide Canepa - 5 Gennaio 2025
Sempre un piacere leggerla, ing. Marzio, sia per l’intrinseco valore delle informazioni che per la chiarezza espositiva non disgiunta da uno stile leggero e simpatico. Grazie e buon anno
Marzio Marigo - 5 Gennaio 2025
Grazie Davide!
🙂